PREVNAR 20
(vaccin antipneumococcique 20-valent conjugué [protéine diphtérique CRM197])
Trouver de l’information pharmaceutique sur PREVNAR 20:
Trouver de l’information pharmaceutique sur PREVNAR 20:
PREVNAR 20 Liens rapides
Note: Les informations ci-dessous incluent la Partie 1 : Renseignements destinés aux professionnels de la santé.
1 Indications
Nourrissons, enfants et adolescents (de 6 semaines à 17 ans)
PREVNAR 20 (vaccin antipneumococcique 20-valent conjugué [protéine diphtérique CRM197]) est indiqué pour l’immunisation active des nourrissons, des enfants et des adolescents âgés de 6 semaines à 17 ans (avant le 18e anniversaire de naissance) afin de prévenir les pneumococcies invasives (y compris la sepsie, la méningite, la pneumonie bactériémique, l’empyème pleural et la bactériémie) causées par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de Streptococcus pneumoniæ.
Adultes (18 ans ou plus)
PREVNAR 20 est indiqué pour l’immunisation active des adultes de 18 ans ou plus afin de prévenir la pneumonie et les pneumococcies invasives (y compris la sepsie, la méningite, la pneumonie bactériémique, l’empyème pleural et la bactériémie) causées par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de Streptococcus pneumoniæ.
L’efficacité clinique pour la prévention de la pneumonie a été étudiée pour les sérotypes de PREVNAR 13 communs à PREVNAR 20 (voir 14 Études Cliniques), mais pas pour les sérotypes additionnels 8, 10A, 11A, 12F, 15B, 22F et 33F.
PREVNAR 20 pourrait ne pas prévenir les maladies causées par les sérotypes de S. pneumoniæ qui ne sont pas compris dans le vaccin.
1.1 Pédiatrie
D’après les données soumises à Santé Canada et examinées par l’organisme, l’innocuité et l’efficacité de PREVNAR 20 ont été établies chez les enfants (de 6 semaines à < 18 ans). Par conséquent, Santé Canada a autorisé une indication pour les enfants de 6 semaines à 17 ans (avant le 18e anniversaire de naissance) (voir 1 Indications, 8.2.1 Effets indésirables observés au cours des études cliniques – enfants et adolescents et 14 Études Cliniques).
1.2 Gériatrie
PREVNAR 20 a fait l’objet d’études chez les personnes âgées (voir 7.1 Populations particulières et 14 Études Cliniques).
2 Contre-indications
PREVNAR 20 est contre-indiqué chez les personnes qui présentent une hypersensibilité à l’ingrédient actif ou à l’un des composants du vaccin, y compris l’anatoxine diphtérique. Pour obtenir la liste complète des ingrédients, veuillez consulter la section 6 Formes pharmaceutiques, teneurs, composition et conditionnement.
4 Posologie et administration
4.1 Considérations posologiques
- On recommande que les personnes qui sont exposées à un risque accru d’infection à pneumocoque, y compris celles qui sont atteintes de drépanocytose ou d’infection par le virus de l’immunodéficience humaine (VIH), de même que celles ayant reçu une ou plusieurs doses du vaccin polysaccharidique 23-valent contre le pneumocoque (VPP23), reçoivent au moins une dose de PREVNAR 20 (voir 7 Mises en garde et précautions, Système immunitaire, et 14 Études Cliniques, Réponse immunitaire à PREVNAR 13 dans des populations particulières).
- Pour les personnes ayant reçu une greffe de cellules souches hématopoïétiques, le calendrier de vaccination recommandé de PREVNAR 20 consiste en quatre doses de 0,5 mL. La primovaccination consiste en trois doses : une première administrée de 3 à 6 mois après la greffe de cellules souches hématopoïétiques et les suivantes après un intervalle d’au moins 1 mois entre chacune des doses. L’administration d’une dose de rappel est recommandée 6 mois après la troisième dose (voir 7 Mises en garde et précautions, Système immunitaire, et 14 Études Cliniques, Réponse immunitaire à PREVNAR 13 dans des populations particulières).
- Si l’administration séquentielle du VPP23 est jugée appropriée, PREVNAR 20 devrait être administré en premier.
4.2 Posologie recommandée et ajustement posologique
4.2.1 Enfants et adolescents (de 6 semaines à 17 ans)
Il est recommandé que, chez tout nourrisson ayant reçu une dose de PREVNAR 20, la série complète de vaccination soit réalisée avec PREVNAR 20.
Calendrier de vaccination systématique pour les nourrissons et les bambins de 6 semaines à 15 mois
Série de 4 doses (3 doses de primovaccination suivies d’une dose de rappel pour les bambins)
La série vaccinale consiste en 4 doses de 0,5 mL chacune de PREVNAR 20. La primovaccination consiste en 3 doses, dont la première est administrée aux bébés de 2 mois (ou dès la 6e semaine de vie), et il faut prévoir un délai de 4 à 8 semaines entre les doses. La quatrième dose doit être administrée au moins 2 mois après la troisième dose, entre l’âge de 11 à 15 mois.
Voir 14.2.2 Études cliniques chez les nourrissons, les enfants et les adolescentes de 6 semaines à 17 ans pour les détails de la série de 3 doses (2 doses de primovaccination suivies d’une dose de rappel pour les bambins)
Nourrissons prématurés (< 37 semaines de gestation)
Le calendrier de vaccination recommandé de PREVNAR 20 consiste en 4 doses de 0,5 mL chacune. La primovaccination consiste en 3 doses, dont la première est administrée aux bébés de 2 mois (ou dès la 6e semaine de vie), et il faut prévoir un délai de 4 à 8 semaines entre les doses. La quatrième dose doit être administrée au moins 2 mois après la troisième dose, entre l’âge de 11 à 15 mois.
Calendrier de vaccination de rattrapage pour les enfants et les adolescents non vaccinés antérieurement, âgés de 7 mois à 17 ans
Chez les enfants de 7 mois à 17 ans qui n’ont jamais reçu de vaccin antipneumococcique conjugué, PREVNAR 20 peut être administré selon les calendriers suivants :
Nourrissons de 7 à 11 mois
Trois doses de 0,5 mL chacune, les deux premières étant données à au moins 4 semaines d’intervalle. La troisième dose est donnée après le premier anniversaire, au moins 2 mois après la deuxième dose.
Enfants de 12 à 23 mois
Deux doses, de 0,5 mL chacune, données à 2 mois d’intervalle.
Enfants et adolescents de 2 à 17 ans
Une seule dose de 0,5 mL.
Calendrier de vaccination de rattrapage pour les enfants ayant déjà reçu en totalité ou en partie les doses de PREVNAR 13
Chez les enfants et les adolescents de 15 mois à 17 ans qui sont considérés comme étant immunisés ou qui ont reçu une série incomplète de doses du vaccin PREVNAR 13, 1 dose unique de 0,5 mL de PREVNAR 20 peut être administrée. La dose de rattrapage (supplémentaire) de PREVNAR 20 doit être administrée au moins 8 semaines après la dernière dose de PREVNAR 13.
4.2.2 Adultes (18 ans ou plus)
PREVNAR 20 est administré par voie intramusculaire en une dose unique de 0,5 mL.
4.4 Administration
Ne pas mélanger PREVNAR 20 avec un autre vaccin ou produit dans la même seringue.
Préparation en vue de l’administration
Étape 1. Remettre le vaccin en suspension Tenir la seringue préremplie à l’horizontale, entre le pouce et l’index, et l’agiter vigoureusement jusqu’à ce que son contenu devienne une suspension blanche homogène. Ne pas utiliser le vaccin s’il ne se remet pas en suspension. |  |
Étape 2. Examiner le vaccin Avant de l’administrer, examiner le vaccin à la recherche de grosses particules et de changement de couleur. Ne pas utiliser le produit en présence de grosses particules ou d’une couleur anormale. Si le produit n’a pas l’aspect d’une suspension blanche homogène, répéter les étapes 1 et 2. | 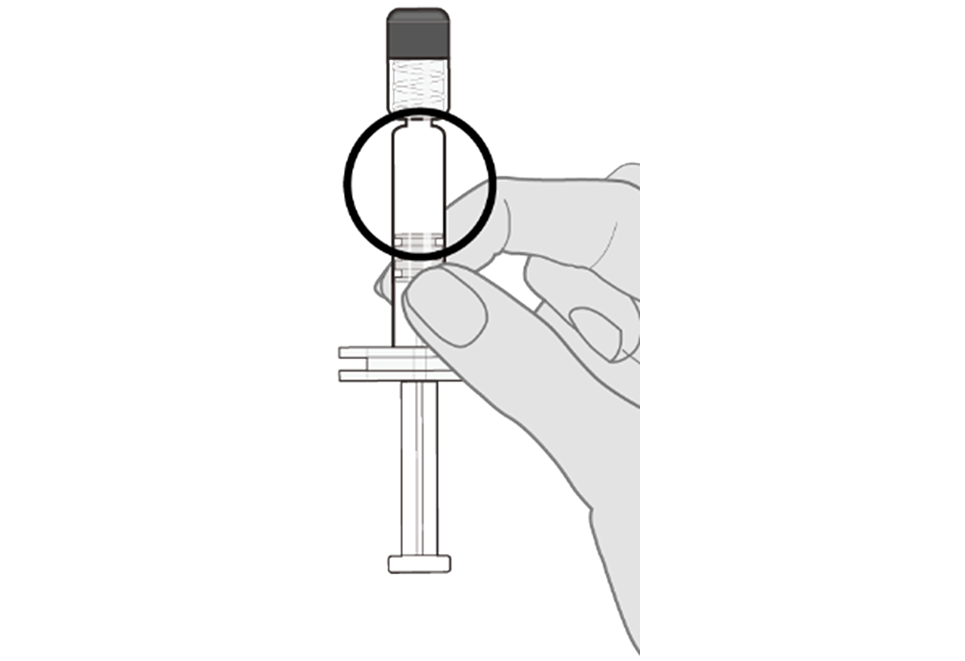 |
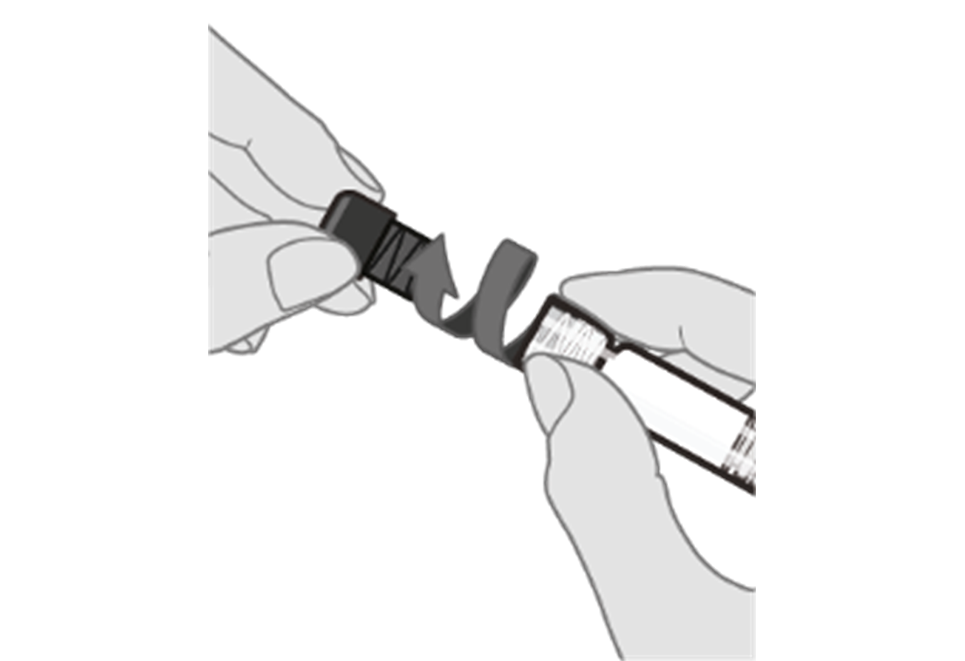
Étape 3. Retirer le capuchon de la seringue Retirer le capuchon de la seringue fixé à l’adaptateur Luer verrouillable en le tournant lentement dans le sens contraire des aiguilles d’une montre tout en tenant l’adaptateur Luer.
Remarque : Il faut veiller à ce que la tige allongée du piston ne soit pas enfoncée pendant qu’on retire le capuchon de la seringue.
|  |
Étape 4. Fixer une aiguille stérile Fixer à la seringue préremplie une aiguille appropriée pour les injections intramusculaires en tenant l’adaptateur Luer verrouillable et en tournant l’aiguille dans le sens des aiguilles d’une montre. | |
Administration
Ce vaccin est réservé à la voie intramusculaire.
Il faut administrer chaque dose de 0,5 mL par injection intramusculaire en prenant soin d’éviter de l’injecter dans un nerf ou un vaisseau sanguin ou à proximité. Les points d’injection privilégiés sont la face antérolatérale de la cuisse pour les nourrissons et le muscle deltoïde (au haut du bras) pour les enfants plus vieux et les adultes. Ne pas injecter le vaccin dans la région fessière.
Ne pas administrer PREVNAR 20 dans un vaisseau sanguin.
5 Surdose
Une surdose de PREVNAR 20 est peu probable à cause de sa présentation en seringues préremplies.
Pour obtenir l’information la plus récente pour traiter une surdose présumée, communiquez avec le centre antipoison de votre région ou avec le numéro sans frais de Santé Canada, 1-844 POISON-X (1844-764-7669).
6 Formes pharmaceutiques, teneurs, composition et conditionnement
PREVNAR 20 est une suspension blanche homogène pour injection intramusculaire présentée dans une seringue unidose préremplie. Chaque dose de 0,5 mL est formulée de manière à contenir environ 2,2 mcg de saccharide pour chacun des sérotypes 1, 3, 4, 5, 6A, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de S. pneumoniæ, 4,4 mcg de saccharide pour le sérotype 6B, 51 mcg de protéine vectrice CRM197, 100 mcg de polysorbate 80, 295 mcg d’acide succinique, 4,4 mg de chlorure de sodium et 125 mcg d’aluminium sous forme de phosphate, à titre d’adjuvant.
PREVNAR 20 est offert en boîtes de 1 seringue unidose préremplie ou de 10 seringues unidoses préremplies, sans aiguilles.
Le capuchon et l’embout du piston de la seringue préremplie ne contiennent pas de latex de caoutchouc naturel.
| Voie d’administration | Forme pharmaceutique/ teneur/composition | Ingrédients non médicinaux |
|---|---|---|
| Intramusculaire | Suspension pour injection 0,5 mL dans une seringue unidose préremplie
| Phosphate d’aluminium Polysorbate 80 Chlorure de sodium Acide succinique Eau pour injection |
Pour aider à faciliter la traçabilité des vaccins aux fins de tenue des dossiers de vaccination des patients ainsi que de pharmacovigilance, les professionnels de la santé doivent noter l’heure et la date d’administration, la dose administrée (le cas échéant), le site anatomique, la voie d’administration, le nom commercial et le nom générique du vaccin, le numéro de lot du produit et la date de péremption.
Description
Suspension blanche pour injection intramusculaire, fournie en seringues unidoses préremplies (0,5 mL).
7 Mises en garde et précautions
Généralités
Comme pour tout vaccin injectable, une surveillance et un traitement médical approprié doivent toujours être disponibles au cas où une réaction anaphylactique, si rare soit-elle, se produirait après la vaccination.
Comme celle de tout vaccin, l’administration de PREVNAR 20 doit être différée chez les personnes atteintes d’une maladie fébrile aiguë sévère. Toutefois, la présence d’une infection sans gravité comme un rhume ne justifie pas le report de la vaccination.
PREVNAR 20 protège seulement contre les sérotypes de Streptococcus pneumoniæ compris dans le vaccin; il ne protège pas contre d’autres microorganismes causant des infections invasives ou la pneumonie.
Comme c’est le cas pour tous les vaccins, il se peut que PREVNAR 20 ne protège pas toutes les personnes vaccinées contre les pneumococcies.
Conduite et utilisation de machines
PREVNAR 20 n’a qu’une faible incidence sinon aucune sur la capacité de conduire et d’utiliser des machines. Cependant, certains des effets mentionnés dans la section 8 Effets Indésirables peuvent influer temporairement sur la capacité de conduire un véhicule ou de faire fonctionner des machines.
Système sanguin et lymphatique
Comme tous les vaccins injectables, PREVNAR 20 doit être administré avec précaution en présence de thrombopénie ou d’un trouble de la coagulation en raison du risque de saignement lié à l’injection intramusculaire.
Système immunitaire
Il n’existe pas de données sur l’innocuité et l’immunogénicité de PREVNAR 20 chez les personnes immunodéprimées; par conséquent, leur vaccination est à envisager au cas par cas. Aucune étude n’a été menée sur l’administration de PREVNAR 20 à des personnes infectées par le VIH, atteintes de drépanocytose ou ayant reçu une greffe de moelle osseuse; cependant, les études portant sur l’innocuité et l’immunogénicité de PREVNAR 13 sont applicables à PREVNAR 20 puisque les deux vaccins sont fabriqués de façon similaire et ont en commun 13 polysaccharides conjugués (voir 14 Études Cliniques).
D’après l’expérience acquise avec les vaccins antipneumococciques, certaines personnes dont l’immunocompétence est altérée peuvent présenter une réponse immunitaire réduite à PREVNAR 20. Il se peut que les personnes dont la réponse immunitaire est amoindrie en raison d’un traitement immunodépresseur, d’une anomalie génétique ou d’une infection par le VIH par exemple, produisent moins d’anticorps en réaction à l’immunisation active. La pertinence clinique de cette observation n’a pas été établie.
Santé reproductive
- Fertilité
Aucune donnée n’a été recueillie chez l’humain quant à l’effet de PREVNAR 20 sur la fertilité.
Les études menées chez l’animal n’ont pas montré d’effets nocifs directs ou indirects sur la fertilité des femelles ni sur la reproduction (voir 16 Toxicologie non Clinique).
7.1 Populations particulières
7.1.1 Grossesse
L’innocuité du vaccin pendant la grossesse n’a pas été établie chez l’humain.
7.1.2 Allaitement
L’innocuité du vaccin pendant l’allaitement n’a pas été établie chez l’humain.
On ne sait pas si les antigènes vaccinaux ou les anticorps passent dans le lait maternel.
7.1.3 Enfants et adolescents
Comme pour tous les vaccins injectables pour enfants, on doit envisager le risque d’apnée lorsque l’on administre la série de primovaccination à des prématurés. Dans le cas de tous les nourrissons prématurés (nés à ≤ 28 semaines de gestation) qui sont encore hospitalisés au moment recommandé pour la vaccination, on doit assurer un suivi d’au moins 48 heures après l’administration du vaccin. Les avantages de la vaccination étant marqués dans ce groupe de nourrissons, l’administration du vaccin ne devrait être ni interrompue ni reportée.
L’efficacité de PREVNAR 20 pour la prévention de la pneumonie n’a pas été établie chez les personnes âgées de moins de 18 ans.
L’innocuité et l’efficacité de PREVNAR 20 n’ont pas été établies chez les enfants âgés de moins de 6 semaines.
7.1.4 Personnes âgées
Sur les 4263 adultes qui ont reçu PREVNAR 20 dans le cadre de trois études de phase III du programme de développement clinique, 668 (15,7 %) avaient entre 65 et 69 ans, 398 (9,3 %) avaient entre 70 et 79 ans et 72 (1,7 %) avaient 80 ans ou plus. PREVNAR 20 s’est révélé sûr et immunogène chez les personnes âgées, quels que soient leurs antécédents en matière de vaccination contre le pneumocoque (voir 14 Études Cliniques).
8 Effets indésirables
8.1 Aperçu des effets indésirables
Adultes de 18 ans ou plus
La marge d’innocuité de PREVNAR 20 est fondée sur l’analyse des données de trois études cliniques de phase III (voir 14 Études Cliniques). Sur les 4263 participants adultes qui ont reçu PREVNAR 20, 3639 n’avaient jamais reçu de vaccin contre le pneumocoque, 253 avaient reçu le vaccin polysaccharidique 23‑valent contre le pneumocoque (Pneumovax® 23 [VPP23]) seulement, 246 avaient reçu PREVNAR 13 seulement, et 125 avaient déjà reçu le VPP23 et PREVNAR 13. Les effets indésirables les plus fréquemment signalés (> 10 %) après sollicitation étaient la douleur ou la sensibilité au point d’injection, les douleurs musculaires, la fatigue, les céphalées et les douleurs articulaires. Dans l’ensemble, les effets indésirables graves signalés concordaient avec les affections observées chez les adultes des différents groupes d’âge, et aucun de ces effets indésirables graves n’a été considéré comme lié au vaccin de l’étude. Lors des trois études de phase III, les marges d’innocuité et de tolérabilité de PREVNAR 20 se sont révélées semblables à celles de PREVNAR 13.
Nourrissons, enfants et adolescents de 6 semaines à 17 ans
L’innocuité de PREVNAR 20 a été évaluée chez 5987 sujets âgés de 6 semaines à 17 ans dans le cadre de 4 études cliniques comparatives avec témoin actif, menées à double insu avec répartition aléatoire ainsi que lors d’une étude clinique à un seul groupe de traitement (1 étude de phase II et 4 études de phase III); 3664 des sujets ont reçu au moins 1 dose de PREVNAR 20, et 2323 sujets ont reçu PREVNAR 13 (vaccin témoin). Dans les 5 études, les groupes PREVNAR 20 et PREVNAR 13 comptaient des proportions comparables de garçons et de filles. Globalement, 83,5 % des sujets du groupe PREVNAR 20 étaient de race blanche, 7,9 %, de race noire, 1,6 %, d’origine asiatique, et 24,0 %, d’origine hispanique; on constatait une distribution similaire dans le groupe PREVNAR 13.
Nourrissons et enfants de 6 semaines à < 15 mois
Des études cliniques ont été réalisées chez des nourrissons et des enfants en bonne santé âgés de 6 semaines à < 15 mois; elles comportaient l’administration d’une série de vaccination de 3 doses (étude de phase II no 1012) ou de 4 doses (études de phase III nos 1011 et 1013 et étude de phase II no 1003). Lors de ces 4 études, 5156 sujets ont reçu au moins 1 dose de vaccin : 2833 ont reçu PREVNAR 20, et 2323 ont reçu PREVNAR 13. Dans l’ensemble, quelque 90 % des sujets de chaque groupe ont reçu toutes les doses prévues dans le protocole, y compris la dose de rappel pour bambins. Dans toutes les études, les réactions locales et les manifestations générales ont été recensées après l’administration de chaque dose; de plus, les manifestations indésirables ont été recensées à partir de l’administration de la première dose jusqu’au premier mois suivant la dernière vaccination des nourrissons ainsi qu’à partir de l’administration de la dose pour bambins jusqu’au premier mois suivant cette dernière. La survenue de manifestations indésirables graves a été évaluée jusqu’au premier mois suivant l’administration de la dernière dose pour l’étude 1012 et jusqu’au sixième mois suivant l’administration de la dernière dose pour les études 1011, 1013 et 1003.
PREVNAR 20 a été bien toléré chez les nourrissons qui ont reçu 3 ou 4 doses : le taux de réactions locales et de manifestations générales sévères s’est révélé faible, et la plupart des réactions se sont résorbées en 1 à 3 jours. Le pourcentage de sujets ayant subi des manifestations de réactogénicité après avoir reçu PREVNAR 20 était généralement comparable à celui noté chez les sujets vaccinés par PREVNAR 13. Chez les nourrissons, les réactions locales et les manifestations générales signalées le plus souvent après l’administration de toute dose de PREVNAR 20 ont été l’irritabilité, la somnolence et la douleur au point d’injection. Dans le cadre des études dont il est question, PREVNAR 13 était administré ou pouvait être administré avec certains vaccins pédiatriques habituels (voir 14.2.3 Administration de vaccins en concomitance).
L’étude 1012, de phase III, comparative avec témoin actif et menée à double insu, portait sur 601 nourrissons en bonne santé âgés de 2 mois (de ≥ 42 à ≤ 112 jours de vie) et nés après plus de 36 semaines de gestation; ils ont reçu une série de 3 vaccinations par PREVNAR 20. Les effets indésirables les plus fréquents (> 10 %) après l’administration de toute dose de PREVNAR 20 ont été l’irritabilité (de 71,0 % à 71,9 %), la somnolence / le sommeil prolongé (de 50,9 % à 61,2 %), la douleur au point d’injection (de 22,8 % à 42,4 %), la perte d’appétit (de 24,7 % à 39,3 %), la rougeur au point d’injection (de 25,3 % à 36,9 %), l’enflure au point d’injection (de 21,4 % à 29,8 %) et la fièvre, soit une température corporelle ≥ 38,0 °C (de 8,9 % à 24,3 %). Dans la plupart des cas, les effets indésirables sont apparus de 1 à 2 jours après la vaccination, étaient d’intensité légère ou modérée et se sont résorbés en 1 à 2 jours.
Les études 1011, 1013 et 1003, comparatives avec témoin actif, avec répartition aléatoire et menées à double insu, portaient sur 2232 nourrissons en bonne santé qui ont reçu une série de 4 doses de PREVNAR 20. Les effets indésirables les plus fréquents (> 10 %) après l’administration de toute dose de PREVNAR 20 ont été l’irritabilité (de 58,5 % à 70,6 %), la somnolence / le sommeil prolongé (de 37,7 % à 66,2 %), la douleur au point d’injection (de 32,8 % à 45,5 %), la perte d’appétit (de 23,0 % à 26,4 %), la rougeur au point d’injection (de 22,6 % à 24,5 %) et l’enflure au point d’injection (de 15,1 % à 17,6 %). La plupart étaient d’intensité légère ou modérée, et très peu de réactions sévères ont été signalées. Dans le cadre de l’étude 1013, les taux de réactions locales et de manifestations générales dans le sous-groupe des prématurés (111 nourrissons nés de 34 à < 37 semaines de gestation) étaient comparables ou inférieurs à ceux observés dans le groupe de nourrissons nés à terme. Dans le sous-groupe des prématurés, les taux de réactions locales de toute nature (entre 31,7 % et 55,3 % dans le groupe PREVNAR 20 et entre 37,9 % et 47,1 % dans le groupe PREVNAR 13) et de manifestations générales de toute nature (entre 65,0 % et 85,5 % dans le groupe PREVNAR 20 et entre 59,4 % et 77,4 % dans le groupe PREVNAR 13) étaient comparables après la vaccination par PREVNAR 20 et la vaccination par PREVNAR 13. Dans la plupart des cas, les effets indésirables sont apparus de 1 à 2 jours après la vaccination, étaient d’intensité légère ou modérée et se sont résorbés en 1 à 3 jours.
La fréquence et la sévérité des effets indésirables survenus dans l’ensemble des études cliniques menées chez des nourrissons ont généralement été comparables dans les groupes PREVNAR 20 et PREVNAR 13.
Enfants et adolescents de 15 mois à 17 ans
Pour les fins de l’étude 1014 (de phase III), 831 sujets de 15 mois à 17 ans répartis en 4 groupes d’âge (209 sujets de 15 à < 24 mois; 216 sujets de 2 à < 5 ans; 201 sujets de 5 à < 10 ans; et 205 sujets de 10 à < 18 ans) ont reçu une seule dose de PREVNAR 20. Les sujets de < 5 ans avaient reçu au moins 3 doses de PREVNAR 13 antérieurement.
Les effets indésirables les plus fréquents (> 10 %) après l’administration de toute dose de PREVNAR 20 chez les sujets de < 2 ans ont été l’irritabilité (61,8 %), la douleur au point d’injection (52,5 %), la somnolence / le sommeil prolongé (41,7 %), la rougeur au point d’injection (37,7 %), la perte d’appétit (25,0 %), l’enflure au point d’injection (22,1 %) et la fièvre, soit une température corporelle ≥ 38,0 °C (11,8 %). Chez les sujets de 2 ans ou plus, les effets indésirables les plus fréquents ont été la douleur au point d’injection (de 66,0 % à 82,9 %), les douleurs musculaires (de 26,5 % à 48,3 %), la rougeur au point d’injection (de 15,1 % à 39,1 %), la fatigue (de 27,8 % à 37,2 %), les céphalées (de 5,6 % à 29,3 %) et l’enflure au point d’injection (de 15,6 % à 27,1 %). Dans la plupart des cas, les effets indésirables sont apparus de 1 à 2 jours après la vaccination, étaient d’intensité légère ou modérée et se sont résorbés en 1 à 3 jours.
8.2 Effets indésirables observés au cours des études cliniques
Étant donné que les études cliniques sont menées dans des conditions très particulières, les taux des effets indésirables qui y sont observés peuvent ne pas refléter les taux observés dans la pratique courante et ne doivent pas être comparés aux taux observés dans le cadre des études cliniques portant sur un autre médicament. Les renseignements sur les effets indésirables provenant des études cliniques peuvent être utiles pour la détermination des effets indésirables liés aux médicaments et pour l’approximation des taux en contexte réel.
Adultes de 18 ans ou plus
Effets indésirables mentionnés sur demande
Le tableau 2 montre la fréquence des effets indésirables mentionnés sur demande par des adultes de moins de 65 ans n’ayant jamais reçu de vaccin antipneumococcique, alors que le tableau 3 montre la fréquence des effets indésirables mentionnés sur demande par des adultes de 65 ans ou plus selon leurs antécédents en matière de vaccination contre le pneumocoque. Les réactions indésirables locales (rougeur, enflure et douleur au point d’injection) étaient mentionnées sur demande quotidiennement, au cours des 10 jours suivant la vaccination. Les manifestations générales (fièvre, fatigue, céphalées, douleurs musculaires et douleurs articulaires) étaient mentionnées sur demande quotidiennement, au cours des 7 jours suivant la vaccination.
De façon générale, la médiane du jour d’apparition des réactions locales se situait entre le jour 1 (jour de la vaccination) et le jour 2,5, et ces réactions locales ont disparu après une durée médiane de 1 à 2 jours. Quant aux manifestations générales, la médiane du jour de leur apparition se situait habituellement, dans la plupart des cas, entre le jour 1 et le jour 3,5, et elles ont disparu après une durée médiane de 1 à 2 jours.
| Effet indésirableb | Étude 1007 De 60 à 64 ans | Étude 1007 De 50 à 59 ans | Études 1007 et 1008 De 18 à 49 ans | |||
|---|---|---|---|---|---|---|
PREVNAR 20 (Na = 991) % | PREVNAR 13 (Na = 990) % | PREVNAR 20 (Na = 331) % | PREVNAR 13 (Na = 111) % | PREVNAR 20 (Na = 1791) % | PREVNAR 13 (Na = 355) % | |
| Réaction locale | ||||||
| Rougeur | 7,1 | 6,3 | 8,2 | 5,4 | 7,4 | 7,3 |
| Enflure | 8,0 | 8,3 | 8,8 | 10,8 | 9,1 | 9,9 |
| Douleur au point d’injection | 61,6 | 59,2 | 72,5 | 69,4 | 79,2 | 77,7 |
| Manifestation générale | ||||||
| Fièvre (≥ 38,0 ℃) | 0,8 | 0,4 | 1,5 | 0,9 | 1,2 | 1,1 |
| Fièvre (> 40,0 ℃) | 0,2 | 0 | 0,3 | 0 | 0 | 0 |
| Fatigue | 32,7 | 32,4 | 39,3 | 36,0 | 46,7 | 43,7 |
| Céphalées | 24,5 | 25,3 | 32,3 | 36,0 | 36,7 | 36,6 |
| Douleur musculaire | 42,8 | 39,8 | 49,8 | 49,5 | 62,9 | 64,8 |
| Douleur articulaire | 12,2 | 14,5 | 15,4 | 20,7 | 16,2 | 15,2 |
a. N : nombre de participants pour lesquels on dispose de données ayant été consignées dans les journaux électroniques après la vaccination. b. Réactions locales mentionnées sur demande au cours des 10 jours suivant la vaccination; manifestations générales mentionnées sur demande au cours des 7 jours suivant la vaccination.
| ||||||
| Effet indésirableb | Étude 1007 | Étude 1006 | |||||
|---|---|---|---|---|---|---|---|
| Antécédents en matière de vaccination contre le pneumocoquec | |||||||
| Aucun vaccin antipneumococcique | VPP23 | PREVNAR 13 | PREVNAR 13 et VPP23 | ||||
PREVNAR 20 (Na = 514) % | PREVNAR 13 (Na = 493) % | PREVNAR 20 (Na = 253) % | PREVNAR 13 (Na = 121) % | PREVNAR 20 (Na = 245) % | VPP23 (Na = 126) % | PREVNAR 20 (Na = 125) % | |
| Réaction locale | |||||||
| Rougeur | 7,8 | 6,1 | 7,9 | 2,5 | 8,6 | 12,7 | 4,8 |
| Enflure | 6,6 | 7,3 | 9,9 | 6,6 | 9,4 | 14,3 | 4,0 |
| Douleur au point d’injection | 43,6 | 44,0 | 50,2 | 43,0 | 61,2 | 56,3 | 52,8 |
| Manifestation générale | |||||||
| Fièvre (≥ 38,0 ℃) | 1,2 | 1,6 | 0,8 | 0 | 0 | 1,6 | 0 |
| Fièvre (> 40,0 ℃) | 0,6 | 0,6 | 0 | 0 | 0 | 0 | 0 |
| Fatigue | 25,3 | 27,2 | 28,9 | 22,3 | 31,0 | 33,3 | 32,8 |
| Céphalées | 15,8 | 19,3 | 17,8 | 18,2 | 13,5 | 21,4 | 19,2 |
| Douleur musculaire | 31,9 | 32,3 | 32,0 | 31,4 | 33,9 | 46,0 | 37,6 |
| Douleur articulaire | 13,4 | 12,0 | 6,7 | 10,7 | 11,8 | 15,9 | 16,8 |
a. N : nombre de participants pour lesquels on dispose de données ayant été consignées dans les journaux électroniques après la vaccination. b. Réactions locales mentionnées sur demande au cours des 10 jours suivant la vaccination; manifestations générales mentionnées sur demande au cours des 7 jours suivant la vaccination. c. Sont inclus les participants ayant déjà reçu soit le VPP23 au moins 1 an, mais tout au plus 5 ans avant leur admission à l’étude (VPP23), soit PREVNAR 13 au moins 6 mois avant l’admission (PREVNAR 13), soit PREVNAR 13 suivi du VPP23, le VPP23 ayant été reçu au moins 1 an avant l’admission (PREVNAR 13 et VPP23). | |||||||
Innocuité en cas d’administration avec d’autres vaccins chez les adultes
Au cours de l’étude 1004, la fréquence de tous les effets indésirables généraux mentionnés sur demande dans les 7 jours suivant l’administration de PREVNAR 20 et d’un vaccin antigrippal contenant un adjuvant (VQI, vaccin quadrivalent inactivé) a été numériquement plus élevée lors de l’administration concomitante des vaccins que lors de leur administration séparée. Par suite de l’administration concomitante, les effets indésirables généraux signalés le plus souvent ont été la fatigue (33,2 %), les céphalées (21,9 %), la douleur musculaire (19,7 %) et la douleur articulaire (13,3 %), généralement d’intensité légère ou modérée (≤ 0,9 % des cas étaient sévères). Le moment de l’apparition et la durée des effets indésirables étaient similaires avec l’administration concomitante et l’administration de PREVNAR 20 ou du vaccin antigrippal seuls. La fréquence de la fièvre a été faible dans les trois groupes – administration concomitante : 1,5 %; PREVNAR 20 seul : 0,5 %; vaccin antigrippal seul : 0,6 %. Aucune autre différence n’a été observée entre l’administration concomitante et l’administration de chaque vaccin seul sur le plan de l’innocuité.
Lors de l’étude 1026, à l’exception de la fièvre, la fréquence de tous les effets indésirables généraux (fatigue, céphalées, frissons, douleur musculaire et douleur articulaire) mentionnés sur demande dans les 7 jours suivant la vaccination dans le groupe administration concomitante était similaire à celle notée dans le groupe vaccin à ARNm contre la COVID-19 seul, mais nettement plus élevée que dans le groupe PREVNAR 20 seul. Dans le groupe administration concomitante, les effets indésirables généraux les plus fréquents ont été la fatigue (54,1 %), la douleur musculaire (32,4 %), les céphalées (30,3 %), les frissons (26,5 %) et la douleur articulaire (26,5 %). La fièvre (13,0 %) et l’utilisation d’antipyrétiques ou d’analgésiques (34,6 %) ont été plus fréquentes dans le groupe administration concomitante que dans le groupe PREVNAR 20 seul (1,1 % et 15,1 %, respectivement) et dans le groupe vaccin à ARNm contre la COVID-19 seul (8,6 % et 28,6 %). La fréquence des effets indésirables mentionnés sur demande qui étaient d’intensité modérée a été plus élevée dans le groupe administration concomitante (fatigue : 33,0 %; céphalées : 11,9 %; douleur articulaire : 11,4 %) que dans les groupes PREVNAR 20 (fatigue : 12,4 %; céphalées : 2,7 %; douleur articulaire : 3,8 %) et vaccin à ARNm contre la COVID-19 (fatigue : 24,9 %; céphalées : 7,6 %; douleur articulaire : 9,7 %) seuls. Aucune autre différence apparente n’a été relevée entre les groupes administration concomitante, PREVNAR 20 seul et vaccin à ARNm contre la COVID-19 seul sur le plan de l’innocuité.
8.2.1 Effets indésirables observés au cours des études cliniques – enfants et adolescents
Enfants et adolescents de 6 semaines à 17 ans
Nourrissons et bambins ayant reçu les doses prévues au calendrier de vaccination systématique
Les tableaux 4 et 5 présentent, respectivement, les taux d’incidence de réactions locales et de manifestations générales, mentionnées sur demande et survenues dans les 7 jours suivant l’administration de chaque dose d’une série de 3 ou de 4 doses de PREVNAR 20 ou de PREVNAR 13.
L’étude 1012 (tableau 4) visait à évaluer une série de 3 doses de PREVNAR 20 ou de PREVNAR 13; la première était administrée entre le 42e et le 112e jour de vie, la deuxième était donnée environ 2 mois plus tard, et la troisième, à l’âge de 11 ou 12 mois. À ces occasions, les sujets ont reçu également d’autres vaccins (voir 14.2.3 Administration de vaccins en concomitance).
Les études 1003, 1011 et 1013 visaient à évaluer une série de 4 doses de PREVNAR 20 ou de PREVNAR 13, administrées à des enfants vers l’âge de 2, 4, 6 et de 12 à 15 mois (12 mois dans le cas de l’étude 1003). À ces occasions, les sujets ont reçu également d’autres vaccins (voir 14.2.3 Administration de vaccins en concomitance). Le tableau 5 présente les données groupées de ces 3 études.
| Dose | Dose 1 | Dose 2 | Dose 3 (pour bambins) | |||
|---|---|---|---|---|---|---|
PREVNAR 20 (Na = 598) % | PREVNAR 13 (Na = 603) % | PREVNAR 20 (Na = 592) % | PREVNAR 13 (Na = 594) % | PREVNAR 20 (Na = 580) % | PREVNAR 13 (Na = 586) % | |
| Réaction locale | ||||||
Douleur au point d’injectionc Sans égard à l’intensité Modérée Sévère |
29,1 12,0 0,3 |
29,4 11,4 0 |
22,8 9,3 0,2 |
24,6 7,9 0,2 |
42,4 17,4 0,3 |
39,9 17,2 0,3 |
Rougeurb Sans égard à l’intensité Modérée Sévère |
25,3 4,5 0 |
27,5 4,8 0 |
28,5 3,7 0 |
28,1 5,1 0,2 |
36,9 13,4 0,2 |
33,8 8,5 0,2 |
Enflureb Sans égard à l’intensité Modérée Sévère |
21,4 8,7 0 |
20,2 7,3 0 |
22,0 8,3 0 |
20,5 6,2 0,2 |
29,8 11,9 0,2 |
24,6 9,7 0,3 |
| Manifestation générale | ||||||
| Irritabilité | 71,9 | 72,5 | 71,6 | 68,4 | 71,0 | 70,8 |
| Somnolence | 61,2 | 63,7 | 51,4 | 50,7 | 50,9 | 48,6 |
| Perte d’appétit | 24,7 | 22,6 | 24,7 | 19,4 | 39,3 | 36,5 |
Fièvre Sans égard à l’intensité (≥ 38,0 ℃) De > 38,9 à 40 ℃ > 40,0 ℃ |
8,9 0 0 |
8,5 0,3 0 |
14,9 0,7 0 |
14,0 0,3 0 |
24,3 3,6 0,3 |
23,7 3,2 0 |
- N : nombre de participants pour lesquels on dispose de données ayant été consignées dans les journaux électroniques après la vaccination. C’est cette valeur qui a servi de dénominateur pour le calcul des pourcentages.
- Sans égard à l’intensité : > 0,0 cm; modérée : > 2,0 à 7,0 cm; sévère : > 7,0 cm.
- Sans égard à l’intensité : toute douleur au point d’injection; modérée : douleur au toucher léger provoquant des pleurs; sévère : douleur limitant le mouvement du bras.
| Dose | Dose 1 | Dose 2 | Dose 3 | Dose 4 (dose pour bambins) | ||||
|---|---|---|---|---|---|---|---|---|
PREVNAR 20 (Na = % | PREVNAR 13 (Na = % | PREVNAR 20 (Na = % | PREVNAR 13 (Na = % | PREVNAR 20 (Na = % | PREVNAR 13 (Na = % | PREVNAR 20 (Na = % | PREVNAR 13 (Na = % | |
| Réaction locale | ||||||||
Douleur au point d’injectionc Sans égard à l’intensité Modérée Sévère |
45,5 17,1 0,2 |
45,4 15,8 0 |
38,6 13,1 0,4 |
39,9 14,0 0,2 |
32,8 11,0 0,1 |
35,5 12,4 0 |
33,4 10,5 0,5 |
34,6 8,9 0 |
Rougeurb Sans égard à l’intensité Modérée Sévère |
23,8 3,7 0 |
23,2 2,5 0 |
23,5 2,6 0 |
25,7 3,7 0 |
24,5 3,7 0 |
25,0 3,5 0,1 |
22,6 4,6 0,1 |
25,6 4,0 0 |
Enflureb Sans égard à l’intensité Modérée Sévère |
17,6 5,1 0,1 |
17,6 4,1 0 |
16,7 4,2 0 |
18,0 4,5 0 |
16,8 4,0 0 |
17,5 3,5 0,2 |
15,1 4,3 0 |
16,0 3,2 0 |
| Manifestation générale | ||||||||
| Irritabilité | 70,6 | 71,5 | 68,4 | 69,9 | 60,8 | 61,4 | 58,5 | 59,4 |
| Somnolence | 66,2 | 65,6 | 52,4 | 54,1 | 39,8 | 41,9 | 37,7 | 38,1 |
| Perte d’appétit | 24,8 | 24,7 | 24,9 | 23,1 | 23,0 | 22,3 | 26,4 | 25,9 |
Fièvre Sans égard à l’intensité (≥ 38,0 ℃) De > 38,9 à 40 ℃ > 40,0 ℃ |
10,3 0,7 0 |
8,5 0,4 0 |
16,5 1,9 0,1 |
15,7 1,6 0 |
12,7 1,6 0 |
13,1 1,8 0 |
16,0 3,2 0,2 |
15,0 3,0 0,1 |
- N : nombre de participants pour lesquels on dispose de données ayant été consignées dans les journaux électroniques après la vaccination. C’est cette valeur qui a servi de dénominateur pour le calcul des pourcentages.
- Sans égard à l’intensité : > 0,0 cm; modérée : > 2,0 à 7,0 cm; sévère : > 7,0 cm.
- Sans égard à l’intensité : toute douleur au point d’injection; modérée : douleur au toucher léger provoquant des pleurs; sévère : douleur limitant le mouvement du bras.
Innocuité en cas d’administration avec d’autres vaccins chez les nourrissons et les bambins
La marge d’innocuité de PREVNAR 20 s’est révélée acceptable et comparable à celle de PREVNAR 13 en cas d’administration avec des vaccins pédiatriques habituels contenant n’importe lequel des antigènes vaccinaux suivants : anatoxine diphtérique, anatoxine tétanique, vaccin acellulaire contre la coqueluche, virus de l’hépatite B, poliovirus, Hæmophilus influenzæ de type b, ainsi que les virus de la rougeole, des oreillons, de la rubéole et de la varicelle (voir 14.2.3 Administration de vaccins en concomitance).
Enfants et adolescents de 15 mois à 17 ans
L’étude 1014 visait à évaluer l’innocuité d’une dose unique de PREVNAR 20 chez des enfants de 15 mois à 17 ans. Le pourcentage d’enfants (par groupe d’âge) ayant subi des réactions locales et des manifestations générales (mentionnées sur demande) dans les 7 jours suivant l’administration d’une seule dose de PREVNAR 20 ou de PREVNAR 13 est présenté au tableau 6. La nature des manifestations générales recensées sur demande pour les sujets de 15 mois à < 2 ans correspondait à celle observée chez les nourrissons; dans le groupe des enfants de ≥ 2 ans, elles devaient être mentionnées verbalement par le sujet.
| Âge | De 15 à < 24 mois | De 2 à < 5 ans | De 5 à < 10 ans | De 10 à < 18 ans | |
|---|---|---|---|---|---|
PREVNAR 20 (Na = 204) % | PREVNAR 20 (Na = 215) % | PREVNAR 20 (Na = 199) % | PREVNAR 20 (Na = 205) % | ||
| Réaction locale | |||||
Rougeurb Sans égard à l’intensité Modérée Sévère |
37,7 7,4 0 |
39,1 15,3 0,9 |
37,2 18,6 2,0 |
3,9 0,5 | |
Enflureb Sans égard à l’intensité Modérée Sévère |
22,1 6,4 0 |
23,3 11,2 0,5 |
27,1 15,6 1,0 |
15,6 10,2 0 | |
Douleur au point d’injectionc Sans égard à l’intensité Modérée Sévère |
52,5 9,8 1,0 |
66,0 17,7 1,4 |
82,9 24,6 1,5 |
82,0 17,6 1,5 | |
| Manifestation généraled | |||||
Fièvre Sans égard à l’intensité (≥ 38,0 ℃) De > 38,9 à 40 ℃ > 40,0 ℃ |
11,8 2,9 0 |
3,3 0,5 0 |
0,5 0 0 |
0 0 0 | |
| Perte d’appétit | 25,0 | - | - | - | |
| Somnolence / sommeil prolongé | 41,7 | - | - | - | |
| Irritabilité | 61,8 | - | - | - | |
| Fatigue | - | 37,2 | 28,1 | 27,8 | |
| Céphalées | - | 5,6 | 18,6 | 29,3 | |
| Douleur musculaire | - | 26,5 | 39,2 | 48,3 | |
| Douleur articulaire | - | 3,7 | 6,5 | 8,3 | |
- N : nombre de participants pour lesquels on dispose de données ayant été consignées dans les journaux électroniques après la vaccination. C’est cette valeur qui a servi de dénominateur pour le calcul des pourcentages.
- Sans égard à l’intensité : > 0,0 cm; modérée : > 2,0 à 7,0 cm; sévère : > 7,0 cm.
- Pour le groupe des 15 mois à < 24 mois : Sans égard à l’intensité : toute douleur au point d’injection; modérée : douleur au toucher léger provoquant des pleurs; sévère : douleur limitant le mouvement du bras. Pour le groupe des 2 à < 18 ans : Sans égard à l’intensité : toute douleur au point d’injection; modérée : qui nuit aux activités; sévère : qui empêche de vaquer aux activités quotidiennes.
- Dans le groupe des 15 mois à < 24 mois, les manifestations générales mentionnées sur demande ont été la fièvre, la perte d’appétit, la somnolence / le sommeil prolongé et l’irritabilité. Dans le groupe des 2 à < 18 ans, les manifestations générales mentionnées sur demande ont été la fièvre, la fatigue, les céphalées, la douleur musculaire et la douleur articulaire.
8.2.2 Renseignements additionnels sur les patients immunodéprimés fournis par les études sur PREVNAR 13
Chez les enfants et les adolescents de 6 à 17 ans vaccinés par PREVNAR 13 qui étaient atteints de drépanocytose, d’une infection par le VIH ou qui avaient subi une greffe de cellules souches hématopoïétiques, la fréquence des effets indésirables était comparable à celle observée dans le groupe des 2 à 17 ans qui avaient reçu PREVNAR 13, sauf pour ce qui est des effets suivants : douleur au point d’injection limitant le mouvement du membre, douleur articulaire, fièvre, céphalées, vomissements, diarrhée, fatigue et douleur musculaire (qui ont tous été très fréquents, soit chez ≥ 1 patient sur 10).
Chez les adultes de 18 ans ou plus infectés par le VIH qui avaient reçu PREVNAR 13, la fréquence des effets indésirables était comparable à celle observée chez les personnes de 18 ans ou plus qui avaient reçu PREVNAR 13, à l’exception de la fièvre et des vomissements, qui étaient dans la catégorie « très fréquents » (≥ 1/10), et des nausées, qui étaient dans la catégorie « fréquents » (≥ 1/100 et < 1/10).
Chez les adultes de 18 ans ou plus ayant subi une greffe de cellules souches hématopoïétiques et ayant reçu PREVNAR 13, la fréquence des effets indésirables était comparable à celle qu’on a relevée chez les personnes de 18 ans ou plus qui avaient reçu PREVNAR 13, à l’exception de la fièvre, de la diarrhée et des vomissements, qui étaient dans la catégorie « très fréquents » (≥ 1/10).
8.3 Effets indésirables peu fréquents observés au cours des études cliniques
Adultes de 18 ans ou plus
Voici la liste des effets indésirables peu fréquents signalés lors des études cliniques sur PREVNAR 20 menées auprès d’adultes (catégorie « peu fréquents » : ≥ 1/1000 et < 1/100).
Troubles du système immunitaire : réaction d’hypersensibilité, y compris œdème facial, dyspnée, bronchospasme
Troubles gastro-intestinaux : diarrhée, nausées, vomissements
Troubles cutanés et sous-cutanés : éruption cutanée, œdème angioneurotique
Troubles généraux et affections au point d’administration : prurit au point de vaccination, lymphadénopathie, urticaire au point de vaccination, frissons
8.3.1 Effets indésirables peu fréquents observés au cours des études cliniques – enfants et adolescents
Les effets indésirables qui se sont produits moins fréquemment chez les enfants de 6 semaines à < 5 ans au cours des études cliniques sur l’emploi de PREVNAR 20 en pédiatrie sont les suivants : vomissements (1,4 %), diarrhée (1,0 %), éruption cutanée (1,0 %), urticaire ou éruption urticarienne (0,5 %), convulsions (dont les convulsions fébriles) (0,4 %) et hypersensibilité au point de vaccination (< 0,1 %).
Les effets indésirables qui se sont produits moins fréquemment chez les enfants de 5 à < 18 ans au cours des études cliniques sur l’emploi de PREVNAR 20 en pédiatrie sont les suivants : urticaire ou éruption urticarienne (0,5 %).
De plus, étant donné que PREVNAR 20 contient les mêmes polysaccharides conjugués capsulaires pour 13 sérotypes et les mêmes excipients que PREVNAR 13, les effets indésirables associés à PREVNAR 13 et énumérés ci-après s’appliquent également à PREVNAR 20. Dans les essais cliniques, la marge d’innocuité de PREVNAR 20 était similaire à celle de PREVNAR 13. La fréquence des effets indésirables est définie comme suit : très fréquents (≥ 10 %), fréquents (entre ≥ 1 % et < 10 %), peu fréquents (entre ≥ 0,1 % et < 1 %) et rares (entre ≥ 0,01 % et < 0,1 %). Pour ce qui est des effets indésirables signalés seulement dans les groupes PREVNAR 13 des études cliniques, mais non signalés dans les études cliniques sur PREVNAR 20, la fréquence est indéterminée chez les personnes vaccinées par PREVNAR 20.
Effets indésirables signalés chez les nourrissons et les enfants de 6 semaines à < 5 ans lors des études cliniques sur PREVNAR 13 :
Troubles du système immunitaire : réaction d’hypersensibilité, y compris œdème facial, dyspnée, bronchospasme (rare)
Troubles du système nerveux : épisode d’hypotonie et d’hyporéactivité (rare), sommeil agité / sommeil réduit (très fréquent)
Troubles psychiques : pleurs (peu fréquents)
Effets indésirables signalés chez les enfants et les adolescents de 5 à < 18 ans lors des études cliniques sur PREVNAR 13 :
Troubles gastro-intestinaux : diarrhée (fréquent), vomissements (fréquent)
Troubles métaboliques et nutritionnels : perte d’appétit (très fréquent)
Troubles du système nerveux : Somnolence / sommeil prolongé (très fréquent), sommeil agité / sommeil réduit (très fréquent)
Troubles psychiques : irritabilité (très fréquent)
Troubles cutanés et sous-cutanés : éruption cutanée (fréquent)
8.5 Effets indésirables observés après la commercialisation
Données relatives à PREVNAR 13 recueillies après la commercialisation
Les effets indésirables présentés ci-dessous, qui ont été signalés depuis la mise sur le marché de PREVNAR 13, ont été sélectionnés parce qu’ils répondaient à au moins un des critères suivants : sévérité, fréquence de signalement et force des données probantes établissant un lien de causalité avec PREVNAR 13. Les effets indésirables signalés chez les enfants et les adultes après la commercialisation de PREVNAR 13 sont susceptibles de survenir après la commercialisation de PREVNAR 20, puisque les ingrédients de PREVNAR 13 sont aussi contenus dans PREVNAR 20.
| Appareil ou système | Fréquence indéterminée |
|---|---|
| Troubles sanguins et lymphatiques | Lymphadénopathie localisée autour du point de vaccination |
| Troubles du système immunitaire | Réaction anaphylactique ou anaphylactoïde, y compris état de choc |
| Troubles de la peau et du tissu sous-cutané | Œdème angioneurotique, érythème polymorphe |
| Troubles généraux et atteintes au point d’administration | Dermatite au point de vaccination, prurit au point de vaccination, urticaire au point de vaccination |
9 Interactions médicamenteuses
Si on administre PREVNAR 20 en même temps qu’un autre vaccin injectable, il faut toujours utiliser une seringue différente et injecter les vaccins à des endroits différents.
PREVNAR 20 ne doit pas être mélangé avec un autre vaccin ou produit dans la même seringue.
Adultes
PREVNAR 20 peut être administré en concomitance avec un vaccin antigrippal quadrivalent contenant un adjuvant (VQI, vaccin quadrivalent inactivé) ou un vaccin à ARNm contre la COVID-19 (voir 14.2.3 Administration de vaccins en concomitance).
Nourrissons et enfants de 6 semaines à < 5 ans
Chez les nourrissons et enfants de 6 semaines à < 5 ans, PREVNAR 20 peut être administré avec n’importe lequel des antigènes vaccinaux suivants, qu’il s’agisse d’un vaccin monovalent ou d’une association : anatoxine diphtérique, anatoxine tétanique, vaccin acellulaire contre la coqueluche, Hæmophilus influenzæ de type b, poliovirus inactivé, virus de l’hépatite B ainsi que les virus de la rougeole, des oreillons, de la rubéole et de la varicelle. Le vaccin a été administré sans danger avec un vaccin antigrippal et un vaccin antirotavirus.
On ne dispose d’aucune donnée sur l’administration concomitante de PREVNAR 20 avec d’autres vaccins.
10 Pharmacologie clinique
10.1 Mode d’action
S. pneumoniæ (pneumocoque) est un diplocoque à Gram positif pouvant causer certaines maladies invasives comme la méningite, la sepsie et la pneumonie avec bactériémie, ainsi que des maladies non invasives comme la pneumonie sans bactériémie. La pneumonie pneumococcique non bactériémique est la maladie pneumococcique la plus courante chez les adultes. Plus de 100 sérotypes de pneumocoques différents ont été identifiés. Les sérotypes contenus dans PREVNAR 20 ont été sélectionnés en fonction de l’importance de leur rôle dans la maladie à l’échelle mondiale. Ils ont été associés à un taux de létalité et à une mortalité plus élevés, à une antibiorésistance, à la méningite et à des éclosions.
PREVNAR 20 contient 20 polysaccharides capsulaires de pneumocoque, tous conjugués à la protéine vectrice CRM197, qui modifie la réponse immunitaire au polysaccharide indépendante des cellules T en la rendant dépendante des cellules T. Cette réponse dépendante des cellules T entraîne une production accrue d’anticorps et induit des anticorps qui favorisent l’opsonisation, la phagocytose et la destruction des pneumocoques (mécanismes de protection contre les pneumococcies) ainsi que la production de cellules B mémoire, ce qui permet d’obtenir une réponse anamnestique (rappel) lors d’une exposition subséquente au polysaccharide bactérien. En l’absence de l’aide des cellules T, les cellules B stimulées par des polysaccharides produisent principalement des anticorps de la classe des immunoglobulines M (IgM); en général, il n’y a aucune maturation de l’affinité des anticorps, et aucune cellule B mémoire n’est produite. L’administration de polysaccharides comme vaccins est associée à une immunogénicité médiocre, voire nulle, chez les nourrissons de moins de 24 mois et à l’absence de mémoire immunitaire chez les personnes de tout âge.
On peut évaluer les réponses immunitaires provoquées chez l’enfant et l’adulte à la suite d’une exposition naturelle à S. pneumoniæ ou de l’inoculation d’un vaccin antipneumococcique en mesurant l’activité opsonophagocytaire (OPA) et la production d’immunoglobuline G (IgG). L’OPA reflète la concentration d’anticorps fonctionnels et est considérée comme une importante mesure immunologique de substitution de la protection contre la pneumococcie chez l’adulte. Chez l’enfant, l’évaluation clinique des vaccins antipneumococciques est réalisée à partir de multiples critères d’immunogénicité, entre autres un taux d’IgG de 0,35 mcg/mL au dosage immuno-enzymatique (ELISA) de l’Organisation mondiale de la Santé (OMS) ou une valeur correspondante obtenue par une méthode équivalente. Les concentrations d’anticorps circulants chez l’adulte et les taux d’IgG dirigés contre certains sérotypes chez l’enfant qui confèrent une protection contre la maladie pneumococcique n’ont pas été clairement établis.
11 Conservation, stabilité et mise au rebut
Conserver PREVNAR 20 au réfrigérateur à une température comprise entre 2 °C et 8 °C (entre 36 °F et 46 °F).
Conserver les seringues au réfrigérateur à l’horizontale pour que le temps de remise en suspension soit réduit au minimum.
Ne pas congeler. Jeter le vaccin s’il a gelé.
PREVNAR 20 doit être administré le plus tôt possible après avoir été retiré du réfrigérateur.
PREVNAR 20 ne peut être administré que si la durée totale des expositions répétées à des températures comprises entre 8 °C et 25 °C n’excède pas 96 heures.
Des expositions répétées à une température variant de 0 °C à 2 °C sont aussi acceptables, pourvu que leur durée totale ne dépasse pas 72 heures. Toutefois, de telles conditions ne sont pas recommandées pour la conservation du produit.
12 Particularités de manipulation du produit
Pendant la période de conservation, un dépôt de couleur blanche et un surnageant clair pourraient être observés dans les seringues préremplies contenant la suspension. Les seringues doivent être conservées à l’horizontale pour que le temps de remise en suspension soit réduit au minimum.
Éliminer le produit inutilisé et les déchets conformément aux exigences locales.
Numéro de contrôle: 299005
29 septembre 2025
Ressources
Vous ne trouvez pas ce que vous recherchez?
Communiquez avec nous.
*Communiquez avec l'information pharmaceutique. 9H00-17H00 ET du lundi au vendredi, excluant les jours fériés.
Envoyez-nous une demande d'information pharmaceutique sur les produits de prescription de Pfizer.
Rapporter un effet indésirable
Communiquez avec le Service de l'innocuité des médicaments de Pfizer ou toute préoccupation concernant la qualité d'un produit de Pfizer:
Vous pourriez aussi communiquer directement avec le Programme Canada Vigilance pour signaler un effet indésirable ou une préoccupation concernant la qualité d'un produit en composant le 1-866-234-2345 ou visitez www.santecanada.gc.ca/medeffet.