NURTEC ODT
(rimégépant)
Trouver de l’information pharmaceutique sur NURTEC ODT:
Trouver de l’information pharmaceutique sur NURTEC ODT:
NURTEC ODT Liens rapides
Note: Les informations ci-dessous incluent la Partie 1 : Renseignements destinés aux professionnels de la santé.
1 Indications
NURTEC ODT (comprimés de rimégépant à dissolution orale) est indiqué pour :
- le traitement ponctuel de la migraine avec ou sans aura chez l’adulte;
1.1 Enfants
Enfants (< 18 ans) : Santé Canada ne dispose d’aucune donnée et n’a donc pas autorisé d’indication pour cette population.
1.2 Personnes âgées
Personnes âgées (≥ 65 ans) : En raison du nombre insuffisant de patients âgés de 65 ans ou plus ayant participé aux études cliniques sur le rimégépant, il est impossible de déterminer s’ils répondent à ce traitement différemment des patients plus jeunes. Aucune différence d’importance clinique n’a été observée entre les patients âgés et les patients plus jeunes quant aux paramètres pharmacocinétiques de cet agent dans le cadre des études pharmacocinétiques.
2 Contre-Indications
NURTEC ODT est contre-indiqué chez les patients qui présentent une hypersensibilité à ce médicament, à un ingrédient de sa présentation, y compris à un ingrédient non médicinal, ou à un composant du contenant. Pour obtenir la liste complète des ingrédients, veuillez consulter la section 6 FORMES PHARMACEUTIQUES, TENEURS, COMPOSITION ET CONDITIONNEMENT.
3 Mises En Garde Et Précautions Importantes
Mises en garde et précautions importantes
Des réactions d’hypersensibilité (dyspnée et éruption cutanée notamment) ont été observées chez moins de 1 % des patients qui ont reçu NURTEC ODT lors des études cliniques. De telles réactions, qui peuvent être graves, peuvent se produire au fil des jours qui suivent l’administration. En pareil cas, il faut cesser immédiatement de prendre NURTEC ODT et instaurer un traitement approprié (voir 2 CONTRE-INDICATIONS).
4 Posologie et Administration
4.1 Considérations posologiques
- Insuffisance hépatique
Il faut éviter d’utiliser NURTEC ODT en cas d’insuffisance hépatique sévère (voir 10.3 Pharmacocinétique).
- Insuffisance rénale
Il faut éviter d’utiliser NURTEC ODT chez les patients atteints de néphropathie terminale (clairance de la créatinine [ClCr] < 15 mL/min) ou sous dialyse (voir 10.3 Pharmacocinétique).
4.2 Posologie recommandée et ajustement posologique
La posologie recommandée est de 75 mg de rimégépant, 1 fois par jour, au besoin.
La dose quotidienne maximale du rimégépant est de 75 mg. L’innocuité de la prise de plus de 15 doses en 30 jours n’a pas été établie.
Personnes âgées
L’expérience acquise avec le rimégépant chez les patients âgés de 65 ans ou plus est limitée. En raison du nombre insuffisant de patients âgés de 65 ans ou plus ayant participé aux études cliniques sur le rimégépant, il est impossible de déterminer s’ils répondent à ce traitement différemment des patients plus jeunes (n = 131 patients traités par le rimégépant). Aucune différence d’importance clinique n’a été observée entre les patients âgés et les patients plus jeunes quant aux paramètres pharmacocinétiques du rimégépant dans le cadre des études pharmacocinétiques (voir 7.1.4 Personnes âgées, 10.3 Pharmacocinétique).
Insuffisance hépatique
Aucun ajustement posologique ne s’impose en cas d’insuffisance hépatique légère (classe A de Child‑Pugh) ou modérée (classe B de Child‑Pugh). La concentration plasmatique du rimégépant était significativement plus élevée en cas d’insuffisance hépatique sévère (classe C de Child‑Pugh). Par conséquent, il faut éviter d’utiliser NURTEC ODT en cas d’insuffisance hépatique sévère (voir 7.1.5 Insuffisance hépatique, 10.3 Pharmacocinétique).
Insuffisance rénale
Aucun ajustement posologique ne s’impose en cas d’insuffisance rénale légère, modérée ou sévère. L’emploi de NURTEC ODT n’a pas été évalué, et doit donc être évité, chez les patients atteints de néphropathie terminale (ClCr < 15 mL/min) ou sous dialyse (voir 7.1.6 Insuffisance rénale, 10.3 Pharmacocinétique).
4.4 Administration
Veuillez fournir les directives d’administration suivantes au patient :
- Veillez à avoir les mains sèches pour ouvrir la plaquette alvéolée.
- Décollez le revers en aluminium d’une plaquette et retirez délicatement le comprimé à dissolution orale (CDO). Ne le poussez pas à travers le revers en aluminium.
- Dès que vous aurez ouvert la plaquette et pris le CDO, placez-le sur votre langue (ou bien sous celle-ci).
- Le CDO sera dissous par la salive; par conséquent, inutile de boire quoi que ce soit pour l’avaler. NURTEC ODT peut être pris avec ou sans aliments.
- Prenez le CDO immédiatement après avoir ouvert la plaquette alvéolée. Ne le conservez pas en dehors de celle-ci en vue d’une utilisation ultérieure.
5 Surdosage
L’expérience clinique en matière de surdosage de NURTEC ODT est limitée. Il n’existe pas d’antidote particulier pour le traitement d’une surdose de rimégépant.
Aucun symptôme de surdosage n’a été rapporté.
Le traitement d’une surdose de NURTEC ODT consiste à prendre des mesures de soutien générales (notamment surveillance des signes vitaux et observation de l’état clinique du patient). Il est peu probable qu’une fraction importante du rimégépant puisse être éliminée par dialyse, étant donné le fort taux de liaison de cet agent aux protéines sériques.
Pour traiter une surdose présumée, communiquer avec le centre antipoison de la région.
6 Formes Pharmaceutiques, Teneurs, Composition Et Conditionnement
|
Voie d’administration |
Forme pharmaceutique / teneur / composition |
Ingrédients non médicinaux |
|---|---|---|
|
Orale |
Comprimé à dissolution orale / 75 mg |
Alcool benzylique, eucalyptol, gélatine, limonène, maltodextrine de maïs, mannitol, menthol, menthone, acétate de menthyle, sucralose et vanilline |
NURTEC ODT se présente sous la forme de comprimés circulaires blancs ou blanc cassé sur lesquels le symbole 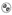 est gravé d’un côté.
est gravé d’un côté.
NURTEC ODT est fourni dans une boîte. Il existe 3 formats d’emballage :
- 1 plaquette alvéolée de 2 CDO fournie dans une boîte;
- 1 plaquette alvéolée de 8 CDO fournie dans une boîte;
- 2 plaquettes alvéolées de 8 CDO (soit 16 CDO en tout) fournies dans une boîte.
7 Mises en Garde et Précautions
Veuillez consulter la section 3 MISES EN GARDE ET PRÉCAUTIONS IMPORTANTES.
7.1 Populations particulières
7.1.1 Femmes enceintes
On ne dispose pas de données adéquates recueillies chez l’humain sur les risques pour le développement embryo-fœtal associés à l’utilisation du rimégépant pendant la grossesse. Les études menées chez les animaux démontrent que l’exposition de ceux-ci à des concentrations de rimégépant d’importance clinique n’a pas entraîné de mortalité embryo-fœtale ni de malformations fœtales. Aucun effet sur le développement n’a été observé chez des rats qui ont reçu des doses de rimégépant pouvant atteindre 60 mg/kg/jour (exposition 46 fois plus élevée que l’aire sous la courbe [ASC] observée chez l’humain à la dose maximale recommandée chez l’humain [DMRH], soit 75 mg/jour) ni chez des lapins qui ont reçu des doses pouvant atteindre 50 mg/kg/jour, soit la dose maximale à l’étude (exposition 10 fois plus élevée que celle associée à la DMRH [75 mg/jour]). Veuillez consulter la section 16 TOXICOLOGIE NON CLINIQUE. NURTEC ODT ne doit être administré durant la grossesse que si les bienfaits attendus pour la mère l’emportent sur les risques pour le fœtus.
7.1.2 Femmes qui allaitent
Une étude sur la lactation a été menée auprès de 12 femmes adultes (de 26 à 37 ans) en bonne santé qui allaitaient et qui ont reçu une dose unique de 75 mg de rimégépant par voie orale de 2 semaines à 6 mois après leur accouchement. Selon les résultats de cette étude, le rapport lait:plasma était de 0,20 en moyenne et la dose relative à laquelle les nourrissons étaient exposés était inférieure à 1 % de la dose maternelle corrigée en fonction du poids. On ne dispose d’aucune donnée sur les effets du rimégépant sur les nourrissons allaités ou sur la production de lait.
Il convient de peser les avantages de l’allaitement pour le développement et pour la santé en regard de la nécessité clinique d’administrer le rimégépant à la mère et des effets indésirables que pourrait subir le nourrisson, qu’ils soient imputables au rimégépant ou à l’affection sous-jacente de la mère.
7.1.3 Enfants
Enfants (< 18 ans) : Santé Canada ne dispose d’aucune donnée et n’a donc pas autorisé d’indication pour cette population.
7.1.4 Personnes âgées
Personnes âgées (≥ 65 ans) : En raison du nombre insuffisant de patients âgés de 65 ans ou plus ayant participé aux études cliniques sur le rimégépant, il est impossible de déterminer s’ils répondent à ce traitement différemment des patients plus jeunes (n = 131 patients traités par le rimégépant). Aucune différence d’importance clinique n’a été observée entre les patients âgés et les patients plus jeunes quant aux paramètres pharmacocinétiques du rimégépant dans le cadre des études pharmacocinétiques (voir 4.2 Posologie recommandée et ajustement posologique).
7.1.5 Insuffisance hépatique
La concentration plasmatique du rimégépant était significativement plus élevée en cas d’insuffisance hépatique sévère (classe C de Child‑Pugh; voir 4.2 Posologie recommandée et ajustement posologique et 10.3 Pharmacocinétique). Par conséquent, il faut éviter d’utiliser NURTEC ODT en cas d’insuffisance hépatique sévère.
7.1.6 Insuffisance rénale
L’emploi du rimégépant n’a pas été évalué, et doit donc être évité, chez les patients atteints de néphropathie terminale (ClCr < 15 mL/min) ou sous dialyse (voir 4.2 Posologie recommandée et ajustement posologique et 10.3 Pharmacocinétique).
8 Effets Indésirables
8.1 Aperçu des effets indésirables
Au total, 1771 patients atteints de migraine ont reçu NURTEC ODT ou une présentation orale bioéquivalente dans le cadre des études comparatives avec placebo visant l’homologation de cet agent pour le traitement ponctuel de la migraine. Dans l’ensemble de ces études, plus de 954 patients ont été traités pendant au moins 12 mois. La plupart des effets indésirables signalés étaient d’intensité légère ou modérée.
8.2 Effets indésirables observés au cours des études cliniques
Étant donné que les études cliniques sont menées dans des conditions très particulières, les taux des effets indésirables qui y sont observés peuvent ne pas refléter les taux observés dans la pratique courante et ne doivent pas être comparés aux taux observés dans le cadre des études cliniques portant sur un autre médicament. Les renseignements sur les effets indésirables provenant des études cliniques peuvent être utiles pour la détermination des effets indésirables liés aux médicaments et pour l’approximation des taux en contexte réel.
Traitement ponctuel de la migraine
L’innocuité de NURTEC ODT pour le traitement ponctuel de la migraine chez l’adulte a été évaluée dans le cadre de 3 essais comparatifs avec placebo, à double insu et à répartition aléatoire, menés auprès de 1771 patients atteints de migraine qui ont reçu une dose de 75 mg de NURTEC ODT ou d’une présentation orale bioéquivalente (voir 14.1 Plan et caractéristiques démographiques de l’étude selon l’indication, Traitement ponctuel de la migraine). Les nausées ont été l’effet indésirable le plus fréquent lors de cet essai. Des réactions d’hypersensibilité (dyspnée et éruption cutanée sévère notamment) ont été observées chez moins de 1 % des patients qui ont reçu NURTEC ODT.
Les effets indésirables observés sont répertoriés dans le tableau 2 suivant la classification par organe, système ou appareil du MedDRA.
|
|
NURTEC ODT n = [#] (%) |
CDO placebo n = [#] (%) |
Comprimé de rimégépant* n = [#] (%) |
Comprimé placebo* n = [#] (%) |
|---|---|---|---|---|
|
Affections gastro-intestinales : nausées |
11/682 (1,6 %) |
3/693 (0,4 %) |
15/1089 (1,4 %) |
11/1089 (1,0 %) |
|
* Données groupées des études 2 et 3. |
||||
Innocuité à long terme
L’innocuité à long terme du rimégépant a été évaluée dans le cadre d’une étude de 1 an menée sans insu où 1197 patients ont reçu en moyenne 6,5 comprimés de rimégépant par période de 4 semaines pendant au moins 6 mois, et 954 patients ont reçu en moyenne 6,6 comprimés de rimégépant par période de 4 semaines pendant au moins 12 mois. Environ 2,6 % des patients ont subi un effet indésirable grave, et 2,7 % des patients ont cessé le traitement par NURTEC ODT à cause d’une réaction indésirable, le plus souvent en raison d’étourdissements. Dans l’ensemble, la marge d’innocuité observée durant cette étude de longue durée sans insu rejoignait celle observée lors des études comparatives avec placebo (études 1, 2 et 3).
8.3 Effets indésirables peu fréquents observés au cours des études cliniques
Réactions d’hypersensibilité
Des réactions d’hypersensibilité (dyspnée et éruption cutanée sévère notamment) ont été observées chez moins de 1 % des patients qui ont été traités lors des études cliniques. De telles réactions peuvent se produire au fil des jours qui suivent l’administration, et des cas graves sont survenus tardivement.
8.4 Résultats anormaux aux épreuves de laboratoire : données hématologiques, données biochimiques et autres données quantitatives
Aucun signal évocateur d’effets néfastes préoccupants sur les résultats des épreuves de laboratoire n’a été décelé dans le cadre du programme de développement clinique de NURTEC ODT.
8.5 Effets indésirables observés après la commercialisation
Aucun nouvel effet indésirable n’a été relevé dans le cadre de l’expérience acquise à l’échelle internationale depuis la commercialisation de NURTEC ODT, ni lors des essais cliniques de phase IV, qui sont toujours en cours.
9 Interactions Médicamenteuses
9.2 Aperçu des interactions médicamenteuses
Études in vitro
- Enzymes
Le rimégépant est un substrat de la CYP3A4 et de la CYP2C9 (voir 9.4 Interactions médicament-médicament). Il n’inhibe pas la CYP1A2, la CYP2B6, la CYP2C9, la CYP2C19, la CYP2D6 ou l’UGT1A1 à des concentrations d’importance clinique. Cela dit, c’est un inhibiteur faible de la CYP3A4 dont les effets dépendent du temps. Le rimégépant n’est pas un inducteur de la CYP1A2, de la CYP2B6 ni de la CYP3A4 à des concentrations d’importance clinique.
- Transporteurs
In vitro, le rimégépant est un substrat de BCRP et de la P-gp, qui sont tous deux des transporteurs d’efflux. Les inhibiteurs de ces transporteurs d’efflux font augmenter la concentration plasmatique du rimégépant. Le rimégépant peut être administré en concomitance avec les inhibiteurs de BCRP et avec les inhibiteurs faibles ou modérés de la P-gp seulement. Il peut aussi être administré en même temps que les inhibiteurs puissants de la P-gp, pourvu que ce soit 1 fois toutes les 48 heures tout au plus, puisque selon une étude sur les interactions cliniques, l’utilisation concomitante d’un inhibiteur puissant de la P-gp et de BCRP (cyclosporine) et celle d’un inhibiteur sélectif de la P-gp (quinidine) ont entraîné des augmentations significatives similaires de l’exposition au rimégépant (augmentation de l’ASC et de la Cmax par un facteur de 1,6 et de 1,4 avec la cyclosporine, et par un facteur de 1,6 et de 1,7 avec la quinidine, respectivement; voir 9.4 Interactions médicament-médicament).
Le rimégépant n’est pas un substrat d’OATP1B1 ni d’OATP1B3. Étant donné sa faible clairance rénale, aucune étude visant à évaluer s’il s’agit d’un substrat d’OAT1, d’OAT3, d’OCT2, de MATE1 ou de MATE2-K n’a été réalisée.
Le rimégépant n’inhibe pas la P-gp, BCRP, OAT1 ou MATE2-K à des concentrations d’importance clinique. Par contre, c’est un inhibiteur faible d’OATP1B1 et d’OAT3.
Le rimégépant est un inhibiteur d’OATP1B3, d’OCT2 et de MATE1. En principe, il ne devrait pas y avoir d’interactions médicamenteuses entre les substrats de ces transporteurs et NURTEC ODT, lorsque le rimégépant atteint une concentration d’importance clinique (voir 9.4 Interactions médicament-médicament).
9.3 Interactions médicament-comportement
L’effet du rimégépant sur la performance sexuelle et la capacité de conduire un véhicule ou d’utiliser des machines n’a pas été étudié. L’interaction entre le rimégépant et le tabac, le cannabis et/ou l’alcool n’a pas été étudiée.
9.4 Interactions médicament-médicament
|
Dénomination commune |
Source des données |
Effet |
Commentaire clinique |
|---|---|---|---|
|
Inhibiteurs de la CYP3A4 (p. ex., clarithromycine, itraconazole, ritonavir, diltiazem, érythromycine, fluconazole, jus de pamplemousse) |
Étude in vivo |
L’administration concomitante d’itraconazole, un inhibiteur puissant de la CYP3A4, et de 75 mg de rimégépant (dose unique) a entraîné une augmentation de l’exposition au rimégépant (ASC 4 fois plus élevée et Cmax ~ 1,5 fois plus élevée) à l’état d’équilibre. L’administration concomitante du rimégépant et d’un inhibiteur modéré de la CYP3A4 (p. ex., fluconazole), à l’état d’équilibre, a fait augmenter l’exposition (ASC) au rimégépant par un facteur de 1,8. Aucune étude consacrée aux interactions médicamenteuses n’a été menée en vue d’évaluer les effets de l’administration concomitante d’un inhibiteur faible de la CYP3A4 et du rimégépant sur les paramètres pharmacocinétiques du rimégépant. En principe, l’administration concomitante d’un inhibiteur faible de la CYP3A4 et du rimégépant ne devrait pas avoir d’effets d’importance clinique sur l’exposition au rimégépant. |
L’administration concomitante de NURTEC ODT et d’inhibiteurs puissants de la CYP3A4 (p. ex., clarithromycine, itraconazole, ritonavir) doit être évitée. La prudence s’impose lors de l’administration concomitante d’inhibiteurs modérés de la CYP3A4 (p. ex., diltiazem, érythromycine, fluconazole). En cas d’administration concomitante d’un inhibiteur modéré de la CYP3A4 (p. ex., fluconazole) et de NURTEC ODT, il faut éviter la prise d’une autre dose de ce médicament dans les 48 heures qui suivent. |
|
Inducteurs de la CYP3A4 (p. ex., phénobarbital, rifampicine, millepertuis [Hypericum perforatum], bosentan, éfavirenz, modafinil) |
Étude in vivo |
L’administration concomitante de rifampicine, un inducteur puissant de la CYP3A4, et de 75 mg de rimégépant (dose unique) a entraîné une diminution de l’exposition au rimégépant (diminution de 80 % de l’ASC et de 64 % de la Cmax) à l’état d’équilibre, qui peut se traduire par une perte d’efficacité. On ignore les effets des inducteurs faibles ou modérés de la CYP3A4 sur les paramètres pharmacocinétiques du rimégépant. Cependant, comme le rimégépant est un substrat de la CYP3A4, les médicaments qui sont des inducteurs modérés de la CYP3A4 peuvent également entraîner une réduction significative de l’exposition à cet agent qui aboutit à une perte d’efficacité lorsqu’ils sont administrés en même temps que lui. En principe, il ne devrait pas y avoir d’interactions médicamenteuses significatives entre les inducteurs faibles de la CYP3A4 et le rimégépant en cas d’administration concomitante. |
L’administration concomitante de NURTEC ODT et d’inducteurs puissants de la CYP3A4 (p. ex., phénobarbital, rifampicine, millepertuis [Hypericum perforatum]) ou d’inducteurs modérés de cette isoenzyme (p. ex., bosentan, éfavirenz, modafinil) est déconseillée. Les effets de l’induction de la CYP3A4 peuvent persister jusqu’à 2 semaines après l’arrêt de l’administration d’un inducteur puissant ou modéré de cette isoenzyme. |
|
Inhibiteurs de BCRP et de la P-gp ou de la P-gp seulement (p. ex., cyclosporine, vérapamil, quinidine) |
Étude in vivo |
L’administration concomitante de 200 mg de cyclosporine (dose unique), un inhibiteur puissant de la P-gp et de BCRP (deux transporteurs), et de 75 mg de rimégépant (dose unique) a fait augmenter l’ASC et la Cmax du rimégépant par un facteur de 1,6 et de 1,4. L’administration concomitante de 600 mg de quinidine (dose unique), un inhibiteur puissant de la P-gp seulement, et de 75 mg de rimégépant (dose unique)a fait augmenter l’ASC et la Cmax du rimégépant par un facteur d’environ 1,6 et 1,7. D’après l’ensemble des résultats obtenus, l’inhibition de BCRP ne devrait pas influer de manière significative sur l’exposition au rimégépant. |
Il faut éviter la prise d’une seconde dose de NURTEC ODT dans les 48 heures qui suivent l’administration d’une première dose avec un inhibiteur puissant de la P-gp (p. ex., cyclosporine, vérapamil, quinidine). |
Autres médicaments
Inhibiteurs de la CYP2C9
Le rimégépant est métabolisé principalement par la CYP3A4 et dans une moindre mesure par la CYP2C9. En cas d’administration concomitante de fluconazole et de rimégépant, l’augmentation de l’exposition à ce dernier est attribuable aux inhibitions combinées de la CYP2C9 et de la CYP3A4. Au cours d’une étude sur les interactions médicamenteuses menée auprès d’adultes en bonne santé, l’administration concomitante d’une dose unique de 75 mg de rimégépant et de fluconazole à l'état d’équilibre (400 mg 1 fois par jour) a fait augmenter l’ASC du rimégépant par un facteur d’environ 1,8, sans toutefois modifier la Cmax de manière notable.
Substrats de MATE1
Dans le cadre d’une étude consacrée à l’évaluation des interactions médicamenteuses chez des adultes non diabétiques en bonne santé, l’administration concomitante, une fois l’état d’équilibre atteint, de 75 mg de rimégépant et de 500 mg de metformine, un substrat du transporteur MATE1, n’a pas eu d’effets d’importance clinique sur les paramètres pharmacocinétiques de la metformine ou l’utilisation du glucose.
Substrats de la CYP3A4 et interactions pharmacodynamiques
Lors d’études consacrées à l’évaluation des interactions médicamenteuses menées auprès d’adultes en bonne santé, le rimégépant n’a pas eu d’effets d’importance clinique sur la pharmacocinétique des contraceptifs oraux (norelgestromine, éthinylestradiol) ou du midazolam (un substrat sensible de la CYP3A4; voir 10.2 Pharmacodynamie).
Dans le cadre d’une autre étude sur les interactions médicamenteuses réalisée auprès d’adultes en bonne santé, l’administration orale de rimégépant à 75 mg (à l'état d’équilibre) n’a pas altéré la pharmacocinétique du sumatriptan, un substrat de l’OCT1 (2 doses de 6 mg administrées par voie sous-cutanée en l’espace de 1 heure). De même, l’administration d’une dose unique de sumatriptan n’a pas eu d’effet notable sur la pharmacocinétique du rimégépant.
Autres antagonistes des récepteurs du peptide lié au gène de la calcitonine (CGRP) :
Lors d’une étude clinique évaluant l’administration concomitante de deux autres antagonistes des récepteurs du CGRP, on a signalé une hausse marquée des cas de constipation. L’emploi concomitant du rimégépant avec d’autres antagonistes des récepteurs du CGRP est donc déconseillé.
9.5 Interactions médicament-aliment
L’administration de NURTEC ODT suivant la prise d’aliments a prolongé le Tmax d’environ 1 à 1,5 heure. La prise de NURTEC ODT 30 minutes après un repas riche en matières grasses a fait baisser l’ASCT du rimégépant de 32 % et de 38 % et sa Cmax de 42 % et de 53 %, respectivement, selon que le produit était placé sous ou sur la langue. De même, l’administration de NURTEC ODT sous la langue 30 minutes après un repas faible en gras a réduit l’ASCT et la Cmax du rimégépant d’environ 28 % et 36 %, respectivement, comparativement à son administration à jeun.
NURTEC ODT a été administré sans égard aux repas lors des études ayant porté sur son efficacité et son innocuité cliniques. On ignore si la diminution de l’exposition au rimégépant attribuable à l’administration du médicament avec des aliments influe sur son efficacité.
9.6 Interactions médicament-plante médicinale
Voir 9.4 Interactions médicament-médicament concernant l’utilisation concomitante de rimégépant et de millepertuis (un inducteur de la CYP3A4).
9.7 Interactions médicament-épreuves de laboratoire
Les interactions entre NURTEC ODT et les épreuves de laboratoire n’ont pas été étudiées.
10 Pharmacologie Clinique
10.1 Mode d’action
Le rimégépant est un antagoniste des récepteurs du peptide lié au gène de la calcitonine (CGRP, de l’anglais calcitonin gene-related peptide). Il se lie de manière sélective et avec une grande affinité aux récepteurs du CGRP et inhibe ainsi l’activité de ces récepteurs.
La relation entre l’activité pharmacodynamique du rimégépant et le ou les mécanismes suivant lesquels ce médicament exerce ses effets cliniques n’a pas été établie.
10.2 Pharmacodynamie
Aucune différence d’importance clinique n’a été relevée entre les effets de l’administration concomitante de rimégépant et de sumatriptan (12 mg fractionnés en 2 doses de 6 mg administrées par voie sous-cutanée à 1 heure d’intervalle) sur la tension artérielle au repos et ceux de l’administration de sumatriptan seulement chez des volontaires en bonne santé.
Le risque d’emploi abusif n’a pas été étudié chez l’humain ni chez l’animal.
Électrophysiologie cardiaque
Lors d’une étude comparative croisée, à répartition aléatoire et à double insu, avec placebo et témoin actif, ayant évalué le tracé électrocardiographique de 38 sujets en bonne santé, l’administration de rimégépant à des doses de 75 et de 300 mg n’a pas eu d’effet pharmacodynamique sur l’intervalle QT.
10.3 Pharmacocinétique
Polymorphisme de la CYP2C9
Les Cmax et les ASC0-∞ du rimégépant observées chez des métaboliseurs intermédiaires des substrats de la CYP2C9 (génotypes *1/*2, *2/*2, *1/*3; n = 43) et des métaboliseurs normaux de ces substrats (génotype *1/*1; n = 72) étaient similaires. On ne dispose pas de données pharmacocinétiques adéquates sur les métaboliseurs lents des substrats de la CYP2C9 (génotype *2/*3; n = 2). Étant donné que le rôle joué par la CYP2C9 dans le métabolisme du rimégépant serait mineur, le polymorphisme de la CYP2C9 ne devrait pas influer de manière significative sur l’exposition à ce médicament.
Absorption
Après l’administration orale de NURTEC ODT, le rimégépant est absorbé de telle sorte qu’il atteint sa concentration maximale en l’espace de 1,5 à 2 heures. La biodisponibilité orale absolue du rimégépant est d’environ 64 %.
Distribution
À l’état d’équilibre, le volume de distribution du rimégépant est de 120 L. Le taux de liaison du rimégépant aux protéines plasmatiques est d’environ 96 %.
Métabolisme
Le rimégépant est métabolisé principalement par la CYP3A4 et dans une moindre mesure par la CYP2C9, surtout sous forme inchangée (≈ 77 %). Aucun métabolite majeur (> 10 %) n’a été décelé dans le plasma.
Élimination
La demi-vie d’élimination du rimégépant est d’environ 11 heures chez les sujets en bonne santé. Après l’administration orale de rimégépant marqué au 14C à des hommes en bonne santé, 78 % de la substance radioactive totale ont été retrouvés dans les fèces et 24 % ont été récupérés dans l’urine. Le rimégépant sous forme inchangée est le principal composé excrété dans les fèces (42 %) et dans l’urine (51 %).
Populations particulières et états pathologiques
- Personnes âgées : Au cours d’études sur les paramètres pharmacocinétiques du rimégépant, ceux-ci n’ont pas différé de manière importante sur le plan clinique chez les sujets âgés (≥ 65 ans) et plus jeunes (18 à 45 ans).
- Sexe : Aucune variation d’importance clinique des paramètres pharmacocinétiques du rimégépant en fonction du sexe n’a été observée.
- Polymorphisme génétique : Aucune variation d’importance clinique des paramètres pharmacocinétiques du rimégépant en fonction du génotype de la CYP2C9 n’a été observée.
- Origine ethnique : Aucune variation d’importance clinique des paramètres pharmacocinétiques du rimégépant n’a été observée lors d’études menées auprès de participants blancs, noirs et japonais.
- Insuffisance hépatique : Dans le cadre d’une étude clinique consacrée à la comparaison des paramètres pharmacocinétiques du rimégépant mesurés chez des sujets atteints d’une insuffisance hépatique légère, modérée ou sévère et de ceux mesurés chez des sujets ayant une fonction hépatique normale (témoins en bonne santé qui leur avaient été appariés), l’exposition au rimégépant (Cmax et ASC) après l’administration d’une dose unique de 75 mg de ce médicament était à peu près 2 fois plus élevée chez les sujets atteints d’une insuffisance hépatique sévère (classe C de Child‑Pugh) que chez ceux qui avaient une fonction hépatique normale. Il n’y avait pas de différence d’importance clinique entre les sujets atteints d’une insuffisance hépatique légère (classe A de Child‑Pugh) ou modérée (classe B de Child‑Pugh) et les sujets qui avaient une fonction hépatique normale en ce qui a trait à l’exposition au rimégépant (voir 4.2 Posologie recommandée et ajustement posologique, Insuffisance hépatique).
- Insuffisance rénale : Dans le cadre d’une étude clinique consacrée à la comparaison des paramètres pharmacocinétiques du rimégépant mesurés chez des sujets atteints d’une insuffisance rénale légère (ClCr estimée = 60-89 mL/min), modérée (ClCr = 30-59 mL/min) ou sévère (ClCr = 15-29 mL/min) et de ceux mesurés chez des sujets ayant une fonction rénale normale (témoins en bonne santé qui leur avaient été appariés), l’exposition totale au rimégépant a augmenté de 6 %, de 40 % et de 4 %, respectivement après l’administration d’une dose unique de 75 mg. NURTEC ODT n’a pas été évalué chez les patients atteints de néphropathie terminale (ClCr < 15 mL/min) ou sous dialyse (voir 4.2 Posologie recommandée et ajustement posologique, Insuffisance rénale).
- Obésité : Aucune variation d’importance clinique des paramètres pharmacocinétiques du rimégépant en fonction du poids corporel n’a été observée.
11 Conservation, Stabilité et Mise au Rebut
Conserver NURTEC ODT à la température ambiante (entre 15 et 30 °C).
12 Particularités de Manipulation du Produit
Voici les directives de manipulation du médicament avant l’administration :
- Veillez à avoir les mains sèches pour ouvrir la plaquette alvéolée.
- Décollez le revers en aluminium d’une plaquette et retirez délicatement le CDO. Ne le poussez pas à travers le revers en aluminium.
- Prenez le CDO immédiatement après avoir ouvert la plaquette alvéolée. Ne le conservez pas en dehors de celle-ci en vue d’une utilisation ultérieure.
Numéro de contrôle: 268384
1er décembre 2023
Ressources
Vous ne trouvez pas ce que vous recherchez?
Communiquez avec nous.
*Communiquez avec l'information pharmaceutique. 9H00-17H00 ET du lundi au vendredi, excluant les jours fériés.
Envoyez-nous une demande d'information pharmaceutique sur les produits de prescription de Pfizer.
Rapporter un effet indésirable
Communiquez avec le Service de l'innocuité des médicaments de Pfizer ou toute préoccupation concernant la qualité d'un produit de Pfizer:
Vous pourriez aussi communiquer directement avec le Programme Canada Vigilance pour signaler un effet indésirable ou une préoccupation concernant la qualité d'un produit en composant le 1-866-234-2345 ou visitez www.santecanada.gc.ca/medeffet.